Intercambiabilità dei biosimilari anche in Italia
Recentemente nell’aula magna della prestigiosa sede dell’Università pontificia gregoriana, a due passi da palazzo Chigi, gremita di esperti della Pubblica Amministrazione e di autorevoli esponenti delle industrie farmaceutiche, AIFA ha presentato il nuovo Position paper sui prodotti biologici, che attendeva un aggiornamento da 5 anni.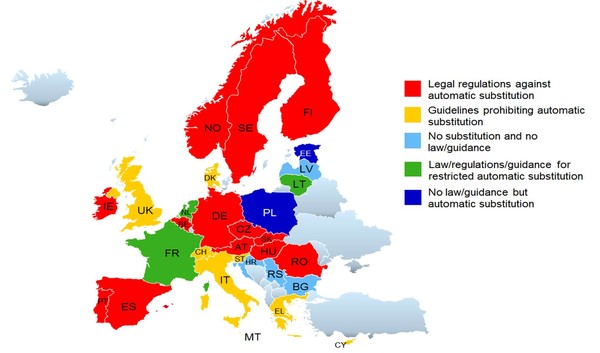
L’immagine (figura 1) di un articolo postato poco meno di un anno fa su Gabionline (1) dà conto della situazione variegata della normativa sulla sostituibilità dei biosimilari nei Paesi membri dell’Europa comunitaria e non. Per quanto attiene all’Italia la situazione risultava simile a quella del Regno Unito, della Danimarca, della Svizzera, della Grecia e di Cipro, dove la sostituzione automatica dei biosimilari era proibita.
Questo deriva da fatto che in Europa le decisioni sulla sostituibilità o sulla intercambiabilità dei biosimilari tra loro o con il prodotto biotecnologico di riferimento non sono assunte dalla Agenzia europea sui medicinali ma dai singoli Stati membri, creando una situazione bizzarra rispetto alla normativa che assegna alla stessa EMA l’istruttoria, la valutazione e la decisione autorizzazione centralizzate su tali prodotti, e alla identificazione della stessa EMA di tali prodotti dotati degli stessi requisiti dell’UE per essere considerati come alternative terapeutiche ai loro biologici di riferimento.
La preoccupazione, legittima e doverosa, sui temi della tracciabilità e della immunogenicità, riguarda la sostituzione automatica, cioè la pratica del passaggio da un prodotto ad un altro a base dello stesso principio attivo biotecnologico, che può essere decisa da un clinico o da un farmacista.
Nel primo caso il fenomeno viene definito switch nel secondo caso intercambiabilità.
La maggior parte degli Stati membri non autorizza la sostituzione automatica e molti hanno introdotto regole per evitare la sostituzione automatica dei biosimilari (2), alcuni hanno permesso una limitata sostituzione dei biosimilari.
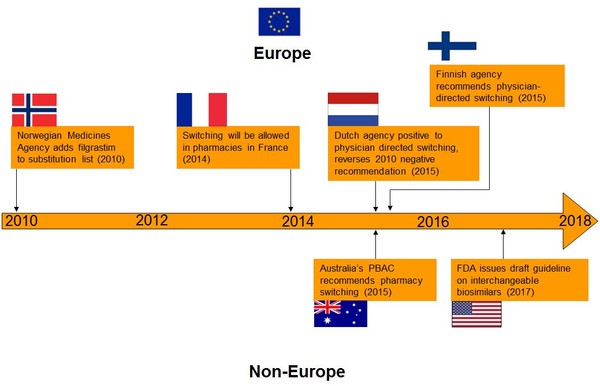
Uno dei più recenti paper su tale situazione (2) mostra che la situazione è in rapida evoluzione come mostrato dalla figura 2. I Paesi che hanno normato sono nel:
2010 la Norvegia
2014 la Francia
2015 l’Olanda
2015 la Australia
2015 la Finlandia
2017 gli Stati Uniti d’America.
Dallo stesso articolo riportiamo le seguenti definizioni:
Switching is defined as a decision by the treating physician to exchange one medicine for another medicine with the same therapeutic intent in patients who are undergoing treatment.
Substitution, on the other hand, is the practice of dispensing one medicine instead of another equivalent and interchangeable medicine in any given patient at the pharmacy level without consulting the prescriber.
Vi sono, però, differenze tra i diversi Paesi che hanno normato sul tema:
- l’Agenzia norvegese per i medicinali ha aggiunto il filgrastim all’elenco di sostituzione nel 2010;
- la Francia ha introdotto (come parte di una nuova legge relativo al bilancio previdenziale) la sostituzione con biosimilare a determinate condizioni: all’inizio del trattamento e se non vietato dal medico prescrittore
- il Medicines Evaluation Board (MEB) nei Paesi Bassi ha mutato la sua raccomandazione negativa del 2010 per dare una raccomandazione positiva allo switch deciso dal medico.
Ma i più recenti interventi sulla normativa nei Paesi europei riguardano non solo lo switch ma anche la sostituzione automatica:
- la Agenzia dei medicinali finlandese, FIMEA, che ha annunciato che considera i biosimilari dell’UE intercambiabili con i loro biologici di riferimento. La sostituzione automatica a livello di farmacia, tuttavia, non è inclusa nell’attuale raccomandazione FIMEA;
- il comitato consultivo per le indennità farmaceutiche (PBAC) dell’Australia ha raccomandato nel 2015 che i biosimilari siano considerati idonei per la sostituzione a livello di farmacia;
- la Food and Drug Administration (FDA) statunitense nel 2017 ha reso pubblica pubblicato la sua bozza di linee guida sull’intercambiabilità dei biosimilari con i loro biologici di riferimento.
La posizione dell’Agenzia italiana.
Il recente position paper interviene sul tema ammettendo la intercambiabilità tra prodotti biosimilari con il proprio prodotto di riferimento, limitandola ai clinici. Il passaggio di maggiore rilievo è il seguente:
“la posizione dell’AIFA chiarisce che i medicinali biologici e biosimilari non possono essere considerati sic et simpliciter alla stregua dei prodotti generici, o equivalenti.
Pur considerando che la scelta di trattamento rimane una decisione clinica affidata al medico prescrittore, a quest’ultimo è anche affidato il compito di contribuire a un utilizzo appropriato delle risorse ai fini della sostenibilità del sistema sanitario e la corretta informazione del paziente sull’uso dei biosimilari. Come dimostrato dal processo regolatorio di autorizzazione, il rapporto rischio-beneficio dei biosimilari è il medesimo di quello degli originatori di riferimento. Per tale motivo, l’AIFA considera i biosimilari come prodotti intercambiabili con i corrispondenti originatori di riferimento. Tale considerazione vale tanto per i pazienti naïve quanto per i pazienti già in cura. “
Nella sostanza AIFA ammette l’intercambiabilità tra biosimilari e bio-originatori ma la limita ai soli clinici e la sottrae ai farmacisti.
Le voci critiche
Non poteva mancare la voce critica di Farmindustria, che attraverso un comunicato ([i]) dello suo Presidente reso in tempo reale al termine della presentazione, fa conoscere il proprio dissenso su questo specifico tema:
«L’industria farmaceutica torna a ribadire – continua – che i biosimilari essendo approvati in un circuito regolatorio europeo hanno l’esatta dignità dei farmaci biologici originator. Sono studiati, sicuri ed efficaci. Ma, come detto nelle premesse del professor Melazzini, non sono uguali. Per questo mi auguro che resti effettivamente nelle mani del clinico la scelta di dare il farmaco più appropriato sulla base delle caratteristiche del paziente. Purtroppo sappiamo che in Italia non va così. Perché si faranno le gare d’acquisto sulla base dell’intercambiabilità e così il medico avrà in mano un solo prodotto, sia esso biologico o biosimilare, perché potrebbe vincere anche l’originator. E questo non garantirebbe la libertà di scelta del medico, che deve decidere in scienza e coscienza» .
Le voci a favore
Tra le voci a favore possiamo sicuramente collocare alcune Regioni che come mostrato nella relazione presentata dai funzionari AIFA e dal Presidente Melazzini traggono proprio dalle gare quei risparmi che dall’introduzione dei biosimilari e dalla loro prescrizione si attendevano.
“ Trend regionali: Piemonte al top, Calabria in coda
In rosso con la spesa farmaceutica sono praticamente tutte le regioni. Ma il quadro dei consumi sui risparmiosi biosimilari è estremamente diversificato a livello regionale. A registrare il maggior consumo di biosimilari per tutte le molecole in commercio sono la Valle d’Aosta e il Piemonte con una incidenza dei biosimilari del 64,11% sul mercato complessivo di riferimento. Seguono, appaiate ma decisamente distanziate dalle prime due, Basilicata e Sicilia dove i biosimilari assorbono rispettivamente il 33,37% e il 32,77% del mercato di riferimento. All’estremo opposto, fanalini di coda la Puglia (6,82%), l’Umbria (7%) e il Lazio (8,27%). Ben altro aspetto assume però la classifica regionale dei consumi tenendo conto soltanto del mercato riferito all’insieme delle quattro molecole in commercio da almeno 3 anni (Epoetine, Filgrastim, Somatropina, Infliximab): in testa ai consumi di biosimilari ancora una volta Valle d’Aosta e Piemonte, entrambe con quote di consumo di biosimilari dell’82,80%. Seguono il Trentino Alto Adige (70,63%), la Liguria (69,99%) passando per la Toscana, L’Emilia Romagna e la Sicilia, tutte con quote di penetrazione dei biosimilari superiori al 60%. Ultima in classifica la Calabria dove il consumo delle quattro molecole biosimilari si ferma al 14,44 per cento.” (3)
La posizione della SIFaCT
Da tempo siamo in presenza, sotto l’aspetto dell’approvvigionamento dei medicinali, di una situazione dinamica e complessa, determinata da:
- la presenza in fase di commercializzazione attuale e prospettica di biooriginatori e dei loro biosimilari
- la presenza di molecole diverse, appartenenti alla medesima categoria terapeutica, già confrontate o confrontabili sul piano del’impiego clinico, in parziale o totale sovrapposizione di indicazioni.
Le due situazioni si possono intrecciare tra loro, dando luogo a diverse alternative possibili di strutturazione dell’“oggetto” di fornitura.
Tuttavia, vale la pena di richiamare alcuni imprescindibili aspetti regolatori che incidono sulle possibili opzioni di acquisto, in relazione a quanto introdotto nell’ordinamento amministrativo di questo secondo Position di AIFA, con particolare riferimento all’impiego alternativo di farmaci biooriginatori e loro biosimilari.
Questo nuovo orientamento regolatorio favorirà presumibilmente la strutturazione in gara di lotti “unici” in cui si confrontano farmaco originatore e suoi biosimilari, ferma restando la possibilità di acquisto di farmaci non aggiudicatari per esigenze specifiche motivate espresse dai clinici.
Per quanto riguarda l’impiego alternativo di molecole diverse, va rammentato che la competenza a definire l’eventuale equivalenza terapeutica è compito esclusivo dell’AIFA, su input regionale, dal 2012.
L’equivalenza sancita dall’AIFA determinerebbe la formazione del c.d. lotto “complesso”, con confronto in gara di molecole diverse.
Viceversa, non percorrendo la strada dell’equivalenza “a monte” della procedura di acquisto, potrebbero venir definire indicazioni prescrittive di cui tenere conto “a valle” di una procedura di “accordo quadro”, con la quale verrebbero contrattualizzati tutti farmaci che possono entrare in ambito prescrittivo.
Tali indicazioni prescrittive, in quanto legittimano, anche sul piano della trasparenza di azione, di corretta allocazione delle risorse pubbliche e di “par condicio” tra gli operatori economici, le scelte di acquisto in fase esecutiva dell’accordo quadro,:
- devono entrare nel procedimento di gara e quindi conosciute preventivamente dai possibili partecipanti
- possono prevedere che, a parità di molecola e indicazione clinica, venga opzionato in fase di acquisto il prodotto offerto a minor prezzo, ovvero quello a maggior punteggio in un confronto qualità-prezzo, se previsto.
Il tutto nell’ambito della valutazione “finale” del medico, cui competono motivate decisioni e responsabilità prescrittiva.
Relativamente all’ipotesi di valutazione della qualità in gara, sarà opportuno che clinici, farmacisti e provveditori, possano effettuare valutazioni comparative tra prodotti mediante l’individuazione di parametrazioni di elementi differenzianti oggettivabili e non, che costituiscono la base per la valutazione della qualità.
Laddove sia presente un differenziale, è corretto proporre una valutazione previa attribuzione di pesi e punteggi che sia in grado di premiare l’investimento di utilità sanitaria e risulta anche corretto verificare se la novità tecnica e tecnologica corrisponda ad una vera innovazione.
Il tema rimane quello della scelta tra due criteri, prezzo più basso o qualità/prezzo, che limitatamente a quest’ultimo, ha visto impegnate alcune Stazioni Appaltanti nell’applicazione ai farmaci, destando ampio interesse, anche se non così estese come ci si sarebbe atteso a seguito della norma che porta al almeno il 70% il valore della qualità. La nostra visione critica su tale ampiezza è già stata esposta (4) risulta coincidente con quella dell’Antitrust con l’AS 1422 del 2.8.2017. (5)
Va detto che le diverse modalità di applicazione regionale che hanno utilizzato criteri di aggiudicazione differenti, con graduatorie basate su quote di impiego diverse legate agli esiti valutativi, e le definizioni di prezzi a base d’asta non coincidenti col prezzo più basso presente sul mercato, costituiscono ulteriori elementi di interesse a fronte della variabilità delle scelte regionali.
Rimane comunque fondamentale il rispetto della libertà prescrittiva, che costituisce un elemento riconosciuto normativamente ed imprescindibile in molte Regioni, condizionato dalle decisioni determinative assessorili nell’ambito delle specifica competenza in termini di governance farmaceutica.
Alla luce di quanto esposto, SIFaCT esprime il proprio apprezzamento rispetto al passo avanti dell’Agenzia regolatoria farmaceutica italiana, consapevole della prudenza sottesa alla decisione di sottrarre per ora questi prodotti all’intercambialità automatica da parte dei farmacisti.
Non può, però, mancare di sottolineare che tale scelta andrà poi coerentemente canalizzata nelle procedure approvvigionative per tener conto dell’esigenze di compatibilità economica finanziaria delle Regioni nel rispetto dei need dei pazienti e dei loro curanti.
I farmacisti pubblici si faranno parte diligenti affinchè questa scelta qualificante operata da AIFA venga adeguatamente inserita anche nelle procedure di comportamento dei clinici, che costantemente sono chiamati a monitorare, nell’ambito della loro normale e quotidiana attività professionale all’interno delle strutture del SSN.
[1] Biosimilar substitution in Europe. Gabioline, 26/5/2017. Sitoweb: http://www.gabionline.net/Reports/Biosimilar-substitution-in-Europe. Accesso del 31.3.2018
[2] The evolution of switching and substitution of biosimilars in Europe. Gabionline, 20/10/2017. Sitoweb: http://gabionline.net/Reports/The-evolution-of-switching-and-substitution-of-biosimilars-in-Europe. Accesso del 31.3.2018
[3] Rosanna Magnano. Biosimilari «intercambiabili» con i farmaci brand, la svolta di Aifa. Il Sole 24 Ore Sanità. 27 marzo 2018 Sitoweb: http://www.sanita24.ilsole24ore.com/art/dal-governo/2018-03-27/biosimilari-intercambiabili-i-farmaci-brand-svolta-aifa-170605.php?uuid=AEyePmOE. Accesso del 31.3.2018
[4] Mauro M. De Rosa.. La novità dell’estate: la qualità/prezzo per l’Antitrust. Editoriale SIFaCT 03 Settembre 2017. Sitoweb: https://www.sifact.it/joomla/index.php/documenti/169-qt-prezzo-antitrast. Accesso del 1/4/2018
[5] AGCM. Sitoweb: http://www.agcm.it/segnalazioni/segnalazioni-e-pareri/open/C12563290035806C/F3461CDA378DB6B5C125817F00508A8A.htmlaccesso del 1.9.2017